
Вуглекислота: властивості, отримання, застосування, поводження, запобігання аваріям та ліквідація їх наслідків
Із засобів масової інформації, часом, надходить інформація про аварії, пов'язані з розгерметизацію посудин під тиском вуглекислого газу (вуглекислоти), що супроводжуються як порушеннями нормальної експлуатації посудин під тиском (закупорка трубопроводів та арматури, утворення льодяної брили), так і вибухами балонів, що приводить, як правило, до травмування людей, руйнування будівель і споруд (детальніше про це трохи нижче).
В цій публікації проаналізовано такі ситуації і на підставі доступних джерел представлені певні висновки, які можуть лягти в основу при складанні плану заходів щодо запобігання цих аварій та ліквідації їх наслідків.
Загальна інформація
Діоксид вуглецю, оксид вуглецю/карбону (IV), двоокис вуглецю/кирбону, вуглекислий газ, СО2, тривка (стійка) хімічна сполука, поширена в природних газах, що містять його в кількості від декількох відсотків до практично чистого вуглекислого газу. В атмосфері Землі міститься близько 0,04% вуглекислого газу. Роль вуглекислого газу в життєдіяльності біосфери полягає, насамперед, у підтримці процесу фотосинтезу, який здійснюється рослинами. Будучи парниковим газом, вуглекислий газ в повітрі впливає на теплообмін планети з навколишнім простором і таким чином бере участь у формуванні клімату планети він легко пропускає ультрафіолетові промені, які обігрівають нашу планету, і відбиває інфрачервоні промені, що випромінюються з її поверхні в космічний простір.
Молекула СО2., складається з одного атому вуглецю і двох рівновіддалених на 1,163 ангстреми (1,163810-10 А) чи 116,3 пікометри атомів кисню, кожен з яких жорстко приєднаний до атому вуглецю подвійним (1ð + 1π) ковалентним полярним зв’язком.
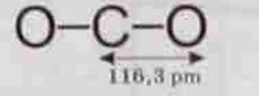
Молекулярна маса СО2 рівна 44 вуглецевим одиницям. За нормальних умов один моль вуглекислоти важить 44 грами, його густина складає 1,98 г/л - приблизно в 1,5 рази більше від повітря.
Часто вживається термін Вугликислота,
Вуглекислота, ж. 1. Кислота, що утворюється внаслідок сполучення вуглекислого газу з водою; вугільна кислота. Водорості можуть використовувати вуглекислоту в такій кількості, яка недоступна для наземних рослин, бо концентрація її в морській воді майже в 10 разів більша, ніж у повітрі (Наука, № 2, 1958, с. 30).
Тверда виглекислота — тверда, схожа на лід речовина, добута шляхом охолодження та зниження тиску стисненої вуглекислоти; "сухии лід". Сухий лід, тобто тверда вуглекислота, виготовляється з рідкої швидким випаровуванням її під зменшеним тиском (Цікава фізика, 1950, с. 189).
2. роям. Неточна назва вуглекислого газу. Людина вбирає з вдихуваного нею повітря кисень і виділяє назовні вуглекислоту і водяну пару (Шк. гігієна, 1954, с. 81).
Утворення, отримання і виробництво
Вуглекислий газ є кінцевим продуктом повного швидкого (горіння) і повільного (гниття, тління) окиснення вугілля та вуглецемістких органічних сполук і речовин:

Процеси анаеробного розкладу і розщеплення вуглеводів здійснюються у харчовій промисловості, а також відбуваються в живих організмах:

В гірництві. Виділення вуглекислого газу відбувається з підошви виробки. За відсутності активного струменя повітря в нижній частині її можуть утворюватися застійні зони з високою концентрацією С02. У рудниковій атмосфері вуглекислий газ присутній завжди, бо утворюється у великій кількості за рахунок біохімічних та хімічних реакцій окиснення, що протікають в гірничих виробках. Звичайно, виділення природного вуглекислого газу в гірничі виробці незначні, винятками є виділення вуглекислого газу магматичного походження в деяких вугільних та калійних родовищах. Гранично допустимий вміст С02 в шахтному повітрі 0,5-1% (за об ємом).
В промисловості найбільш розповсюджені 3 способи отримання вуглекислого газу:
• з відхідних газів хімічних виробництв, перш за все синтетичного аміаку і метанолу (у відхідному газі міститься приблизно 90% діоксиду вуглецю);
• з димових газів промислових котелень, що спалюють природний газ, вугілля та інше паливо (в димових газах міститься 12-20% діоксиду вуглецю);
• з відхідних газів, що утворюються при бродінні в процесі отримання пива, спирту, при розщепленні жирів (відхідний газ представляє собою майже чистий діоксид вуглецю).
Фізичні властивості
Безбарвний газ (за нормальних умов), має кислуватий смак і запах, не горить, не підтримує горіння і дихання; неотруйний газ; має парникові властивості (сприяє утриманню тепла на поверхні Землі і вносить основний вклад у глобальне потепління).
При 200С в 1 об’ємі води розчиняється 0,88 об’ємів СО2. Водний розчин його має кислуватий смак. Сатурацією (нагнітанням вуглекислоти) у воду або у різноманітні водні розчини отримують "мінералку" та інші газовані напої (включно з "шампанським" - за методом «швидкої шампанізації»).
Фазові перетворення
Вуглекислий газ СО2 (вуглекислота, двоокис вуглецю/карбону, діоксид вуглецю/карбону, вугільний ангідрид) в залежності від тиску і температури може знаходитися в газоподібному, рідкому або твердому стані.
Під тиском приблизно 60 атм діоксид вуглецю за звичайної температури перетворюється в рідину. У зрідженому стані у сталевих балонах його можна зберігати і транспортувати.
При виході з балона він частково випаровується, а частково, при охолодженні, моментально перетворюється в пластівці сухого білого снігу. Саме це і спостерігається при випуску газу з вогнегасника під час гасіння пожежі (чи підриві запобіжного клапану посудини під тиском вуглекислого газу).
При розгерметизації посудини під тиском вуглекислого газу і його витоку спричиняється локальне сильне охолодження, С02 при -78,5 С перетворюється у снігоподібну масу (сухий лід), яка сублімує (випаровується не плавлячись).
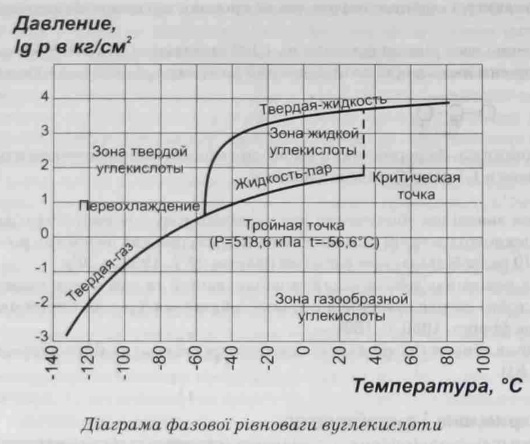
Рідкий діоксид виглеию (виглекислота) представляє собою безбарвну рідину без запаху. При кімнатній температурі вона існує лише при тиску понад 585 кПа (5,85 МПа, або 57,4 атм). Густина рідкої вуглекислоти сильно залежить від температури. Наприклад, при температурі нижче +110С рідка вуглекислота важча за воду, при температурі вище +110С - легша. У результаті випаровування 1 кг рідкої вуглекислоти за нормальних умов утворюється приблизно 509 л газу. При температурі близько -56,60С і тиску 519 кПа (0,519 МПа, 5,19 атм) рідка вуглекислота перетворюється у тверду речовину - «сухий лід».
Якісні показники.
Згідно з ГОСТ 8050-85 газоподібна й рідка вуглекислота постачається трьох видів: вищого, першого і другого Гатунків. Допустимий вміст вуглекислого газу і деяких домішок у різних марках вуглекислоти наведено в таблиці 1.

Виробництво сихого льоду пресуванням полягає в дроселюванні рідкої вуглекислоти з конденсатора при тиску - 70 атм в проміжну посудину до тиску 16-20 атм і потім в порожну пресу, в якому підтримують тиск, близький до потрійної точки. У результаті внизу пресу утворюється снігоподібна вуглекислота («виглекислий сніг») й пари її відсмоктуються першою ступенею компресора. Потім ці пари разом з парами з проміжної посудини стискаються на другій ступені компресора до 70 атм і скеровуються до конденсатору, а отримана в ньому рідка вуглекислота - на виробництво «вуглекислого снігу».
Хімічні властивості
Речовини, що мають більше споріднення до кисню, ніж вуглець, можуть віднімати у нього кисень. Так, наприклад, запалена свічка гасне в атмосфері С02, а запалена магнієва стрічка продовжує горіти:
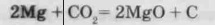
З водою діоксид вуглецю утворює нестійку вугільну кислоту:
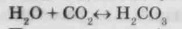
При проходженні вуглекислого газу через шар розжареного вугілля він частково відновлюється до оксиди вуглеию/карбони (11). або монооксиди (окис) виглеию/карбони, більш відомому як світи льн и іі (освітлю вальнийі чи чадний газ (або «тихий ибивия»).
На відміну від монооксиду діоксид вуглецю є солетворним оксидом— ангідридом карбонатної (вугільної) кислотмН2СО3
При пропусканні вуглекислого газу через вапняну воду спричиняє її помутніння (утворюється нерозчинний карбонат кальцію):
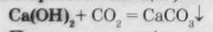
При иропусканні вуглекислого газу через водні розчини лугу (наприклад, гідроксиду натрію чи калію) утворюються карбонати і гідрокарбонати - соду і поташ:

Взаємодією аміакуйдіоксиду вуглецюпритемпературі 1300С і тиску 100 атм у водному розчині отримують карбамід (сечовину) - цінне мінеральне добриво:
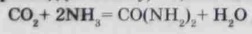
Дія на організм людини
Відомо, що вміст вуглекислого газу в крові людини в нормі складає 6,0-6,5%, при цьому в здорової людини співвідношення систолічного і діастолічного тисків (верхньої і нижньої меж) складає приблизно 135/75 мм рт.ст. Подальше збільшення концентрації вуглекислого газу в крові сприятиме зниженню артеріального тиску, і при зниженні діастолічного тиску до 59 мм рт.ст. і нижче, життя людини може обірватися.
Шляхи надходження вуглекислого газу в організм людини традиційні: з повітрям, що вдихається, і з продуктами харчування (особливо, газованими напоями; саме тому не рекомендується вживати сильно газованих напоїв людям з пониженим артеріальним тиском). В організмі людини вуглекислота разом з бікарбонатами утворює важливу буферну систему крові. Підвищення рівня парціального тиску С02 у крові збільшує міцність зв’язку кисню з гемоглобіном. Не діючи (у тому числі безпосередньо) на центри подовгастого мозку, вуглекислота бере участь в регуляції дихання і кровообігу. Суміш кисню (95%) і вуглекислоти (5%) - так званий карбоген - використовують для лікування отруєнь наркотиками, чадним газом та ін.
Токсична дія СО2 виявляється за вмісту його в повітрі 3-4% і полягає в подразненні дихальних шляхів, запамороченні, головному болі, шумі у вухах, психічному збудженні, викликає нудоту і непритомний стан. У великих концентраціях викликає гіпоксію. При концентрації вище 6% (так званий критичний рівень) втрачається працездатність, з’являються сонливість, ослаблення дихання і сердечної діяльності, виникає небезпека для життя, а при 10% і більше — смертельно: великі концентрації вуглекислоти (або тривала його експозиція) викликають сильний ацидоз (закислення), задишку, судоми і параліч (зупинку) дихального центру.
У таблиці 2 вказані прийнятні та небезпечні рівні концентрації вуглекислого газу (СО2) у повітрі робочих зон згідно стандартів ASHRAE і OSHA (США).

Фармакологічна дія: Вуглекислота постійно утвориться в тканинах організму в процесі обміну речовин і відіграє важливу роль в регуляції дихання і кровообігу. Вона надає пряме і рефлекторне (через каротидні клу-бочки) вплив на дихальний центр і є його специфічним збудником.
Вдихання невеликих концентрацій вуглекислоти (3-5-7%) викликає почастішання і поглиблення дихальних рухів і збільшення легеневої вентиляції; одночасно збуджуються судинорухові центри, в зв’язку з чим відбувається звуження кровоносних судин і підвищується артеріальний тиск.
Показання до застосування: Вуглекислоту застосовують з киснем при гнобленні діяльності дихального центру: при отруєннях леткими наркотиками, окисом вуглецю, сірководнем, при асфіксії (відсутність дихання) новонароджених і т. п.
У хірургічній практиці її застосовують під час наркозу і після операції для стимулювання дихання, для попередження ателектазу легень (спадання легеневої тканини) і пневмоній (запалення легенів). Вдихання вуглекислоти показано також при судинному колапсі (різкому падінні артеріального тиску).
При різкому ослабленні дихання застосування вуглекислоти повинно проводитися з обережністю, так як в результаті недостатньої вентиляції вона може накопичитися в організмі в надлишковій кількості. У цих випадках можуть спостерігатися такі ж ускладнення, як при застосуванні вуглекислоти у великих концентраціях.
Рідка вуглекислота, що випускається з балона, поміщеного вниз вентилем, потрапляючи в умови кімнатної температури і звичайного тиску, швидко випаровується, при цьому поглинається так багато тепла, що вона перетворюється на тверду білу снігоподібну масу. Цим користуються при заморожуванні тканин для гістологічних зрізів (зразків тканини для мікроскопічних досліджень). Якщо змішати твердий вугільний ангідрид з ефіром, то температура падає до -80 С.
Спосіб застосування: Для стимуляції дихання і судинного центру використовують інгаляції 5-7% вуглеця кислоти з 93-95% кисню.
"Вуглекислий сніг" має застосування при лікуванні шкірних захворювань (при червоному вовчаку, лепрозних вузлах, бородавках і т. п.). «Вуглекислий сніг» збирають у спеціальні мішечки, потім набивають у формочки з картону або скляні трубочки і прикладають до ділянок шкіри, що підлягає руйнуванню. Є дані про ефективність заморожування вогнищ ураження шкіри (кріотерапія) при нейродермітах (захворюваннях шкіри, зумовлених порушенням функції центральної нервової системи).
Напої, що містять у розчиненому вигляді вуглекислоту (газовані напої), викликають гіперемію (почервоніння) слизової оболонки і посилюють секреторну (виділення травного соку), всмоктувальну і рухову активність шлунково-кишкового тракту.
Вуглекислота, що міститься в природних мінеральних водах, які використовуються для лікувальних ванн (наприклад, нарзан-ванни), може надавати складний вплив на організм, викликаючи виникнення доцентрових імпульсів з рецепторів шкіри і поява рефлекторних змін у діяльності серцево-судинної системи та інших органів, а також зміна трофіки (живлення) тканин.
Побічні дії: При вдиханні вуглекислоти в надмірній концентрації може розвинутися ацидоз (закислення), сильна задишка, втрата свідомості, посмикування м’язів, судоми, кома (повна втрата свідомості, що характеризується відсутністю реакції організму на зовнішні подразники), зупинка дихання внаслідок паралічу дихального центру.
Протипоказання: Різке послаблення дихання.
Захисні газові суміші з вуглекислотою
Найбільш розповсюдженими є такі захисні газові суміші з вуглекислотою:
• суміш аргону з вуглекислим газом (зазвичай 18-25%) - ефективна при зварюванні низьковуглецевих і низьколегованих сталей. У порівнянні зі зварюванням у чистому аргоні або вуглекислому газі легше досягається струменевий перенос електродного металу; зварні шви більш пластичні, ніж при зварюванні у чистому вуглекислому газі й менша імовірність утворення пор у порівнянні зі зварюванням у чистому аргоні;
• суміш вуглекислоти з киснем: з низьким вмістом кисню (30% - для зварювання) і низьким вмістом вуглекислоти (до 7% - для медико-фармацевтичного застосування). При додаванні до вуглекислоти кисню знижується розбризкування при зварюванні, покращується формування шва, підвищується виділення тепла, яке дещо підвищує продуктивність зварювання, проте, в результаті підвищеного окислення погіршуються механічні властивості швів. Медико-фармацевтичний вплив суміші вуглекислого газу й кисню детально описано вище;
• суміші вуглекислоти з азотом, вуглекислоти з азотом і киснем, вуглекислоти з воднем тощо використовуються у харчовій промисловості. Наприклад, суміші ВІОМІХ застосовуються для пакування харчових продуктів з метою тривалого їх зберігання; для розливу пива і квасу з кегів (дозволяє зберегти натуральний і природній смак і колір;
• суміші інертних і активних газів (аргон, вуглекислий газ, кисень) мають технологічні переваги перед чистим вуглекислим газом: готова газова суміш, наприклад, марки АГАМІКС зменшує розбризкування електродного металу на 5-10%, покращує формування шва і робить процес зварювання менш чутливим до коливань напруги та швидкості подачі дроту.
Газові суміші можуть готуватися як на заводах-виробниках, так і на місці застосування за допомогою простого об’ємного змішування з використанням ротаметрів (газових витратомірів) чи застосуванням більш зручних газових змішувачів для подвійних сумішей, наприклад, стандартний змішувач УКП-1-71 чи М в 50/100-2 ЕСО (фото) та інші.
Застосування
Діоксид вуглецю знайшов широке застосування:
У хімічній промисловості: при виробництві соди, сечовини та інших сполук; також служить для нейтралізації лужних стічних вод; у закритих умовах вуглекислий газ використовується в процесах очищення або осушування полімерів, волокон тваринного або рослинного походження;
У целюлозно-паперовій промисловості: після лужного відбілювання деревної маси або целюлози дозволяє з високою точністю регулювати рівень рН в переробленій сировині; в процесах нейтралізації талової оливи і з метою підвищення продуктивності папероробних машин;
У харчовій промисловості: у виробництві цукру, вина, пива, для виготовлення газованої води, шампанського тощо. Як консервант Е 290, вуглекислий газ дозволяє надовго зберегти продукти в свіжому вигляді (вуглекислота обмежує життєдіяльність шкідливих мікроорганізмів, знищуючи їх тільки в умовах високої концентрації; з 37 форм гнильних бактерій тільки 5 не піддаються її дії). Спресований твердий СО2, під назвою "сухий лід" застосовують для охолодження м’яса, риби й інших харчових продуктів, що швидко псуються. Видалення кофеїну з кави здійснюється з використанням вуглекислого газу в надкритичному стані;
В агрохімії: для підгодівлі рослин у захищеному ґрунті. Застосування вуглекислоти для живлення рослин ґрунтується на процесі фотосинтезу: листя рослин за допомогою хлорофілу поглинають вуглекислоту повітря і разом з водою переробляють її в поживні органічні речовини, необхідні для їх розвитку і зростання; цей процес супроводжується виділенням кисню, тобто відбувається газообмін на основі дихання рослин;
У техніці: для виготовлення свинцевих білил; в якості захисної атмосфери при зварюванні, а також у деяких фізико-хімічних процесах. Вуглекислий газ захищає розплавлений метал від шкідливого впливу повітря, чим забезпечує високу міцність зварювальним швам; шліфування з застосуванням вуглекислоти дозволяє зменшити витрату абразивів і машинний час, а у вигляді снігу використовується для абразивного очищення деталей або видалення осадів на кристалічних пластинах; теплові напруження при цьому зменшуються, що дозволяє уникнути тріщин на обробленій поверхні; у лазерній техніці; вуглекислий газ в надкритичному стані є рухливою фазою, що використовується як в процесі хроматографічного аналізу, так і в процесах екстрагування;
У металургії: для осадження бурого диму в процесах завалки брухту і закачування вуглецю, для скорочення об’єму поглинання азоту в процесі відкриття електродугових печей, а також для донного перемішування; для осадження диму в процесі ковшового транспортування Штейна (виробництво Cu/Ni або злитків (виробництвоZn/Pb);
У гірництві: для здійснення безполуменевих вибухів. За даними досліджень застосування вуглекислоти у вигляді добавок до водного розчину, що нагнітається у пласт, або у вигляді облямівки, яку просуває по пласту закачаний розчин, нафтовіддача зростає до 10% порогового об’єму пласта; у невеликих кількостях рідка вуглекислота може використовуватися при рециркуляції води в процесі відведення кислотних шахтних вод;
В енергетиці: для регулювання реакторних температур - в якості теплоносія реакторів, що дозволяє створення одноконтурних АЕС з газотурбінними установками закритого циклу на вуглекислому газі;
У протипожежному захисті: для ефективної боротьби з пожежами (припиняти горіння і швидко охолоджувати джерело займання при вивільненні вуглекислоти з вогнегасника, балона, спринклера тощо);
У лікувально-оздоровчих закладах: при оперативних та реанімаційних процесах (як самостійно, так і в сумішах з киснем і азотом); у вигляді «вуглекислого снігу» - для лікування шкірних захворювань; а сухий лід швидко знижує температуру і при випаровуванні не залишає рідини (використовується для ефективного охолодження тканин при транспортуванні й трансплантації органів); а також у бальнеології (широко відомі природні джерела діоксиду вуглецю у вигляді мінеральних вод «Нарзан», «Боржомі» та інші);
У метеорології: застосовується в якості засобу для поліпшення погоди в туманні дні (розсіювання туману, розгін хмар).
Постачання
Вуглекислота постачається споживачу і зберігається у балонах, залізничними й автомобільними цистернами (причепами), стаціонарними посудинами під тиском різної місткості, що встановлюються на залізничних платформах або кузовах вантажних автомобілів (рисунок 1).

При невеликих обсягах споживання вуглекислого газу і для постачання використовуються балони. В стандартний чорний балон (з жовтим написом «Вуглекислота») ємністю 40 л (рисунок 2) заливають 25 кг рідкої вуглекислоти, яка зберігається під тиском 5-6 МПа (50-60 атм). При випаровуванні 25 кг рідкої вуглекислоти утворюється приблизно 12 600 л газу.
Для відбору газу з посудини вона повинна оснащуватися редуктором, підігрівачем газу й, за потреби, осушувачем газу. При виході вуглекислого газу з посудини в результаті його розширення відбувається адіабатичне охолодження газу. Висока витрата газу (більше 18 л хв.) може призвести до замерзання парів води, що міститься у газі, й закупорці редуктора. У зв’язку з цим між редуктором і вентилем балону бажано розміщувати підігрівач газу. При проходженні газу змійовиком він підігрівається електричним нагрівальним елементом, ввімкненим у мережу з напругою 24 або 36 Вольт.
Для видалення вологи з вуглекислоти застосовується осушувач газу. Він представляє собою корпус, заповнений матеріалом (зазвичай силікагелем, мідним купоросом чи алюмогелем), що добре всотує вологу. Осушувачі бувають високого тиску, що встановлюються до редуктора, і низького тиску, що встановлюються після редуктора.
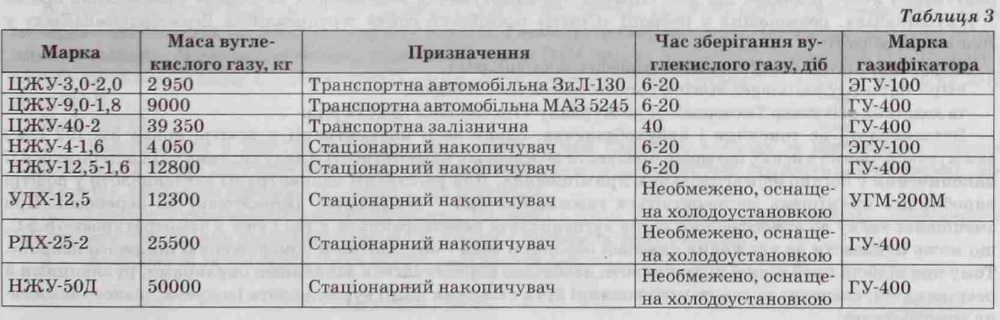
Для перевезення і зберігання значних обсягів вуглекислоти використовуються сталеві ємності, характеристики для найпоширеніших з них наведені у таблиці 3.
Нещасні випадки на виробництві, пов'язані з вуглекислотою
У ЗМІ є повідомлення про такі випадки, наприклад:
1. На Єнакіївському металургійному заводі (Донецька область) 8 серпня 2013 року приблизно об 14:00 в конверторному цеху стався випадок виробничого травматизму з двома слюсарями-ремонтниками.
Під час виконання ремонтних робіт при розкритті гідравлічного затвору установки попереднього охолодження сталося отруєння двох робітників вуглекислим газом.
Потерпілі госпіталізовані у міську лікарню Єнакієвого. Також в лікарню скеровані двоє працівників з підрядної організації, які першими прийшли на допомогу потерпілим.
За попередніми даними, причиною події став людський фактор - недотримання техніки безпеки на виробництві.
2. Працівник ВАТ «Мозирпиво» надихався випарами вуглекислого газу і загинув.
Трагедія сталася в цеху безалкогольних напоїв 23 червня 2013 року. Установлено, що під час виконання налагоджувальних робіт мужчина 1956 р.н., який працював слюсарем, спустився без захисних засобів дихання всередину накопичувальної ємності купажного напою на 3 метри, (загальний об’єм ємності - 6 кубометрів), де знаходилися залишкові пари вуглекислого газу. Робітник, втративши свідомість, загинув.
3. Вибух балона з вуглекислотою у пункті продажу квасу з кеґів у Саратовській області в липні 2013 року, внаслідок якого загинула продавець, кілька сторонніх людей були травмовані, припарковані поряд автомобілі - пошкоджені, уламок сталевого листа влетів у вікно автобусу, що проїжджав мимо (на щастя, без жертв). За попереднім висновком, аварія сталася внаслідок високої температури зовнішнього оточуючого середовища, яка спричинила різке підвищення тиску в балоні, що і призвело до його вибуху.
4. Є інформації з багатьох підприємств-виробників пиво-безакогольної продукці про розгерметизацію посудин під тиском вуглекислоти (внаслідок перевищення тиску підрив і неповернення на місце запобіжного клапану, руйнування розривної мембрани та ін.)
Основними причинами аварій і нещасних випадків на виробництві є:
• низький рівень виробничого контролю за додержанням вимог промислової безпеки;
• порушення трудової і виробничої дисципліни;
• експлуатація устатковання ненавченим і неатестованим обслуговуючим персоналом (неякісні або формальні навчання й інструктажі з питань охорони праці);
• несвоєчасні ревізії посудин під тиском чи запобіжних клапанів (або регуювання тиску їх спрацювання/закриття не на спеціалізованому стенді), використання розривних мембран поганої якості, або таких, що не відповідають умовам експлуатації (для швидкої ліквідації аварійної ситуації слід завжди мати в запасі розривні мембрани і запобіжні клапани, відрегульовані на спеціальному стенді);
• дія зовнішніх чинників (екстремальні температури внаслідок як природніх факторів, так і пожеж, вибухів й аварій на сусудніх технологічних об’єктах тощо).
Як відомо, основними причинами вибухів балонів є:
• механічні пошкодження внаслідок ударів, падінь;
• нагрівання різними джерелами тепла (сонячними чи інфрачервоними променями);
• корозійні пошкодження в процесі експлуатації;
• переповнення стиснутим газом;
• неправильне використання з порушенням правил техніки безпеки;
• несправність запірної арматури;
• заправлення балонів поза межами стаціонарних спеціалізованих майданчиків (не на вагу, а «під пробку», без попередньої дефектоскопії балона).
Безпечне поводження з вуглекислотою
Перш за все, слід відмітити, що вуглекислота (особливо зріджена!) є небезпечним продуктом, транспортування якого підпадає під дію «Правил транспортування небезпечних вантажів» (докладніше про це - у публікаціях, розміщених у рубриці «Статті» офіційного сайту теруправління Держгірпромнагляду у Львівській області:
http://dgpn.lviv.ua/irnages/stories/yunoshev/docs/snk.pdf і
http://dgpn.lviv.ua/images/stories/yunoshev/docs/nebezll3.pdf
Вуглекислота не токсична і вибухобезпечна, однак за її концентрації у повітрі понад 5% (92 г/м3) знижується частка кисню, що може призвести до кисневої недостатності й задухи; тому слід остерігатися її накопичення у погано перевітрюваних приміщеннях. Для реєстрації концентрації вуглекислоти у повітрі виробничих приміщень застосовуються газоаналізатори - стаціонарні автоматичні чи переносні. При зменшенні тиску до атмосферного рідка вуглекислота перетворюється у газ і сніг з температурою -78,5 С, що може призвести до ураження слизової оболонки очей і носоглотки й обмороженню шкірного покрову. Тому при відборі проб рідкої вуглекислоти необхідно користуватися захисними окулярами, рукавицями й респіратором; спецодяг та спецвзуття повинні бути стійкими до дії вуглекислоти (зокрема, різкого зниження температури).
Через це заправляти вуглекислотою посудини чи балони слід на спеціалізованому підприємстві, площадкитяких оснащені відповідним технологічним устаткованням, протиаварійними засобами, забезпечені кваліфікованим навченим і тренованим на випадок нештатної ситуації персоналом.
Починати заправлення можна тільки порожнього балону. Якщо в ньому зберігається певна кількість рідкої вуглекислоти, то остання частково перетворюється у газ і створює тиск.
Перевірити - заправлений балон чи ні, можна ваговим способом (за збільшенням його ваги), а також візуально (поява інею на його зовнішніх стінках, якщо заправлення відбувається у теплому приміщенні).
Перед заправленням балону його слід оглянути (стравлюється залишковий газ під тиском, відгвинчується штуцер, проводиться внутрішйній візуальний огляд балона за допомогою лампи, потім нагвинчується штуцер, балон опресовується під тиском до 10 Мпа, і лише після витравлювання повітря надходить на наповнення вуглекислотою "на вагу" (20 кг).
У випадку спрацювання (і неповернення на місце) запобіжного клапану посудини, що працює під тиском вуглекислоти, можна спостерігати «снігопад у липні», коли газоподібний вуглекислий газ внаслідок різкого падіння тиску сильно охолоджується, і швидко охолоджує навколишнє повітря, спричиняючи утворення «снігу» як з охолодженого СО2, та і з вологи повітря.
У випадку руйнування розривної мембрани, вуглекислота практично миттєво перетворюється у лід і швидко перекриває весь перетин аварійно-скидного трубопроводу, а також формує внутрі посудині міцну льодову брилу, шо крайнє повільно випаровується навіть при підведенні тепла ззовні (див. діаграму). У такому випадку слід відгріти ділянку аварійно-скидного трубопровода і встановити нову захисну мембрану. Після цього слід провести внутрішній огляд ємності. Цистерну необхідно відігріти до температури оточуючого середовища, а внутрішню ємність продути повітрям або провентилювати. Огляд внутрішньої частини посудини, що використовувалася для зберігання й транспортування рідкої вуглекислоти, необхідно проводити в шланговому протигазі (протигаз дозволяється не використовувати лише після того, як об’ємна частка вуглекислоти внутрі ємності стане нижчою за 0,5%). Якщо рівень льоду у посудині перевищує третину її геометричного об’єму відігрівання посудини є недоцільним внаслідок дуже повільного процесу сублімації (випаровування твердої вуглекислоти, минуючи стадію зрідження), тому після встановлення нової захисної розривної мембрани слід перевірити герметизацію посудини і підвищувати компресором тиск у ній до граничного, внаслідок чого тверда вуглекислота почне зріджуватися (див. діаграму) і посудина швидше повернеться до умов нормальної експлуатації. Після цього рекомендується якнайшвидше вивести дану посудину з експлуатації у нормальному режимі й зробити позапланове її опосвідчення.
Ігор ТЕРЕХ,
заступник начальника територіального управління Держгірпромнагляду у Львівській області
Сергій КОЛІВОШКО,
за ступник начальника Державної інспекції нагляду у газовому господарстві і хімічній промисловості теруправління Держгірпромнагляду у Львівській об ласті
ПАРТНЕР "Технополиса" №2 2015
|